- DIÈNES ET POLYÈNES
- DIÈNES ET POLYÈNESLes diènes et polyènes sont des hydrocarbures dont la molécule renferme deux ou plusieurs liaisons éthyléniques. La nature n’en fournit que d’assez rares représentants qui sont apparentés aux terpènes. Encore, dans ce domaine, seuls quelques diènes et triènes acycliques sont-ils natifs, l’un des diènes les plus simples, l’isoprène CH2=C(CH3) 漣CH=CH2, résultant de la pyrolyse de plusieurs terpènes et polyterpènes naturels. Les autres sont accessibles par de nombreuses synthèses.Ces hydrocarbures ont un intérêt théorique très important; l’étude de leurs propriétés physiques et chimiques a fourni de précieux renseignements pour le développement de la théorie structurale moléculaire et celui des mécanismes réactionnels. Leur intérêt pratique n’est pas moindre: le caoutchouc naturel est un polymère indéfini (polyisoprène) et la polymérisation de certains diènes conduit à des élastomères qui, peu à peu, détrônent le produit naturel. Le rôle biologique de certains polyènes tels que les carotènes, les polyterpènes et les provitamines mérite également d’être souligné.Diènes cumulésLes diènes possédant deux doubles liaisons sur le même atome de carbone de la chaîne sont appelés carbures alléniques, de l’ancien nom du plus simple d’entre eux, le propadiène ou allène H2C=C=CH2. Le système allénique isolé n’a jamais été signalé dans un composé naturel, on le rencontre cependant deux fois en position conjuguée dans la chaîne de l’antibiotique Mycomycine extrait de moisissures Norcardia acidophilus (formule 1).StructureLa structure électronique des diènes cumulés comporte deux liaisons 神 indépendantes ( 神z et 神y ), résultant du recouvrement latéral des orbitales pz des carbones 1 (sp2) et 2 (sp) et des orbitales py des carbones 2 (sp) et 3 (sp2). Le recouvrement maximal impose aux plans xy et xz des liaisons 靖 extérieures au bloc cumulé d’être perpendiculaires. Une isomérie optique résulte de cette situation pour les allènes qui portent deux substituants différents sur les carbones 1 et 3. Postulée par J. H. Van ’t Hoff en 1874, celle-ci a été confirmée expérimentalement en 1935 par le dédoublement du diphényl-1,3 di 見-naphtyl-1,3 allène (Mills et Maitland).PréparationL’allène est préparé par déshalogénation au zinc du 2,3-dichloropropène, obtenu par addition de HCl au chlorure de propargyle. Récemment, il a été fabriqué, en mélange 20/80 avec son isomère méthylacétylène, par craquage du propène à 300 0C: les proportions de ce mélange correspondent à l’équilibre thermodynamique à cette température.Une méthode générale de préparation des allènes, à partir d’alcènes, fait intervenir la déchloration de gem -dichlorocyclopropanes résultant de l’addition, sur un alcène, du dichlorocarbène.L’action d’un organomagnésien aliphatique sur le bromure de propargyle est un autre mode d’obtention de ces composés:
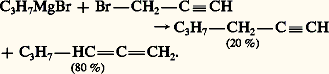 Les esters de propargyle réagissent également avec les cuprates en donnant des allènes:
Les esters de propargyle réagissent également avec les cuprates en donnant des allènes: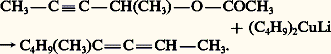 Des réactions très générales de déshydrohalogénation de dihalogénures, géminés ou vicinaux, donnent des allènes, en mélange avec leurs isomères acétyléniques.Propriétés chimiquesLes propriétés chimiques des allènes sont essentiellement celles de deux alcènes indépendants.Sous l’action des bases fortes comme NaNH2, un hydrogène allénique est arraché, laissant un anion mésomère que le solvant reprotone et, de proche en proche, la triple liaison migre jusqu’à l’extrémité de la chaîne carbonée qui, correspondant à un alcyne vrai, se trouve transformée en sel de sodium.Diènes conjuguésPréparationsLes diènes conjugués contiennent deux doubles liaisons séparées par une simple liaison.Le butadiène-1,3 et le 2-méthylbutadiène-1,3 ou isoprène sont les deux plus importants diènes conjugués. Le premier est une matière intermédiaire industrielle essentielle pour la fabrication d’élastomères. Le second est le monomère duquel dérivent formellement de nombreuses substances naturelles de la famille des terpènes et des stéroïdes et que l’on désigne par le nom d’isoprénoïdes [cf. TERPÈNES]; il est lui-même un monomère fabriqué industriellement.Le butadiène-1,3 est extrait de la coupe C4 résultant du vapocraquage de naphta (cf. PÉTROLE - Le pétrole brut), généralement par distillation extractive à l’aide d’acétonitrile ou de N-méthylpyrrolidone. On le prépare également par déshydrogénation catalytique des butènes et du butane sur alumine à 600 0C en présence de vapeur d’eau.Les diènes symétriques ramifiés proviennent de l’action du sodium sur les halogénures vinyliques.La plupart des synthèses conduisent à des mélanges dès que l’on s’éloigne des tout premiers termes, du fait des isoméries cis-trans de la double liaison et des réactions d’isomérisation. La synthèse la plus spécifique est basée sur la réaction de Wittig d’un ylure de phosphonium sur un dérivé carbonylé 見-éthylénique.Structure et propriétés physiquesLa structure électronique des diènes conjugués comporte un enchaînement de quatre atomes de carbone consécutifs, hybrides sp2, échangeant deux doublets 神. Du recouvrement latéral des quatre orbitales pz résultent quatre orbitales moléculaires tétracentriques, de symétrie 神; les deux plus stables étant, dans l’état fondamental, liantes et doublement occupées et les deux autres, antiliantes et inoccupées. Le recouvrement maximal des orbitales p z impose le parallélisme des axes z et, par conséquent, la coplanéité des quatre noyaux de carbone et des six autres atomes auxquels ils sont liés par le système des liaisons 靖. La situation de conjugaison du système 神 des diènes conjugués correspond à une énergie de la molécule inférieure d’environ 10 kJ.mol-1 à celle de leurs isomères ayant deux liaisons 神 séparées. Ces hydrocarbures diéniques présentent une bande d’absorption intense dans la région 215-230 nm, qui correspond à une transition 神2神3 et se trouve déplacée de 30 à 35 nm vers les grandes longueurs d’onde par rapport à la bande équivalente des alcènes. De même, la vibration caractéristique en infrarouge est située vers 1 600 cm-1, alors que celle des alcènes se trouve dans la région 1 620-1 690 cm-1.Propriétés chimiquesLes diènes conjugués réagissent, comme les alcènes, dans des réactions d’additions électrophile et radicalaire, mais avec une vitesse généralement supérieure.De plus, les produits, formés au cours d’une réaction en deux étapes, sont souvent des mélanges d’isomères résultant d’additions en position 1,2 et 1,4 et dans des proportions qui dépendent de la température et du solvant. Par exemple, l’addition, à 漣 60 0C, de l’acide bromhydrique au butadiène conduit à un mélange de bromo-3 butène-1 et de bromo-1 butène-2 dans un rapport 4/1; si la réaction a lieu à 40 0C, la proportion des isomères est inversée: 1/4; l’orientation de la réaction est de nature cinétique. À température plus élevée, cette deuxième étape devient réversible et, cette fois, l’orientation est de nature thermodynamique, c’est-à-dire que le produit le plus stable (addition 1,4) est le plus abondant. L’addition du brome à température ordinaire, dans le solvant CCl4, conduit à un mélange de dibromo-1,4 butène-2 trans (95 p. 100) et de dibromo-3,4 butène-1 (5 p. 100). La chloration du butadiène en phase vapeur, à 300 0C, est une réaction radicalaire en chaîne; elle aboutit à un mélange de 3,4-dichlorobutène-1 et de 1,4-dichlorobutène-2 cis et trans . Seul le premier isomère étant utilisé pour la fabrication du chloroprène (2-chlorobutadiène-1,3), on isomérise réversiblement le 1,4-dichlorobutène-2 par chauffage en présence de chlorure cuivreux et on sépare le 3,4-dichlorobutène-1 par distillation. Le chloroprène est obtenu par déshydrochloration de ce dérivé, à 85 0C, à l’aide de soude diluée; c’est un monomère important pour la fabrication de matières plastiques insensibles aux huiles, ainsi que d’adhésifs.Les diènes conjugués donnent lieu à de nombreuses réactions de cycloaddition, notamment avec les composés insaturés activés (Diels-Alder 1928). Ces additions -1,4 sur le diène, d’un composé appelé diénophile, se font généralement par simple chauffage; elles procèdent par un mécanisme concerté. Le diène doit réagir dans sa conformation (la moins favorable) s-cis et l’addition étant réalisée en une seule étape (addition syn ), la configuration du diénophile et celle du diène sont conservées dans l’adduit. La cycloaddition la plus simple est celle de l’éthylène sur le butadiène-1,3: elle se produit à 200 0C et sous pression et conduit, avec un faible rendement (20 p. 100), au cyclohexène (réaction 2 a). La vitesse de réaction est fortement accélérée si le diénophile est activé par des groupes électro-attracteurs et le diène par des groupes électro-donneurs. L’acroléine, l’anhydride maléique, l’acétylène dicarboxylate d’éthyle sont de bons diénophiles; l’isoprène, le 2,3-diméthylbutadiène-1,3, le cyclopentadiène, le furanne sont des diènes réactifs.Cyclooligomérisation : en présence de catalyseur à base de tétrachlorure de titane TiCl4 et de chlorodiéthylaluminium ClAl (C2H5)2, le butadiène se trimérise en formant le cyclododécatriène-1,5,9 accompagné de petites quantités de cyclooctadiène-1,5 et de vinyl-4 cyclohexène. Hydrogéné catalytiquement, cet oligomère donne le cyclododécane, matière première de la fabrication du nylon 12 [cf. AMIDES].Polymérisation : lorsque le diène conjugué est terminal, il peut être polymérisé sous l’action de divers catalyseurs. Le butadiène fut d’abord polymérisé par le sodium, pour former un élastomère appelé Buna (butadien-natrium). La copolymérisation du butadiène et du styrène en émulsion sous l’action catalytique de peroxydes conduit à un caoutchouc synthétique (S.B.R.), utilisé pour la fabrication des pneumatiques. Certains terpolymères à base de butadiène, styrène et acrylonitrile fournissent des matériaux plastiques aux qualités remarquables (résines A.B.S.). Le caoutchouc naturel, qui est un polyisoprène-1,4 cis , se trouve concurrencé par de nombreux polyènes de synthèse, obtenus par polymérisation ou copolymérisation de diènes conjugués (butadiène, isoprène) et de dérivés vinyliques divers.Diènes éloignésCe sont des diènes dont les doubles liaisons sont séparées. Leur préparation fait intervenir les méthodes classiques de synthèse. Un exemple particulier est celui de la synthèse du pentadiène-1,5 par la réaction de Wurtz appliquée au bromure d’allyle:
Des réactions très générales de déshydrohalogénation de dihalogénures, géminés ou vicinaux, donnent des allènes, en mélange avec leurs isomères acétyléniques.Propriétés chimiquesLes propriétés chimiques des allènes sont essentiellement celles de deux alcènes indépendants.Sous l’action des bases fortes comme NaNH2, un hydrogène allénique est arraché, laissant un anion mésomère que le solvant reprotone et, de proche en proche, la triple liaison migre jusqu’à l’extrémité de la chaîne carbonée qui, correspondant à un alcyne vrai, se trouve transformée en sel de sodium.Diènes conjuguésPréparationsLes diènes conjugués contiennent deux doubles liaisons séparées par une simple liaison.Le butadiène-1,3 et le 2-méthylbutadiène-1,3 ou isoprène sont les deux plus importants diènes conjugués. Le premier est une matière intermédiaire industrielle essentielle pour la fabrication d’élastomères. Le second est le monomère duquel dérivent formellement de nombreuses substances naturelles de la famille des terpènes et des stéroïdes et que l’on désigne par le nom d’isoprénoïdes [cf. TERPÈNES]; il est lui-même un monomère fabriqué industriellement.Le butadiène-1,3 est extrait de la coupe C4 résultant du vapocraquage de naphta (cf. PÉTROLE - Le pétrole brut), généralement par distillation extractive à l’aide d’acétonitrile ou de N-méthylpyrrolidone. On le prépare également par déshydrogénation catalytique des butènes et du butane sur alumine à 600 0C en présence de vapeur d’eau.Les diènes symétriques ramifiés proviennent de l’action du sodium sur les halogénures vinyliques.La plupart des synthèses conduisent à des mélanges dès que l’on s’éloigne des tout premiers termes, du fait des isoméries cis-trans de la double liaison et des réactions d’isomérisation. La synthèse la plus spécifique est basée sur la réaction de Wittig d’un ylure de phosphonium sur un dérivé carbonylé 見-éthylénique.Structure et propriétés physiquesLa structure électronique des diènes conjugués comporte un enchaînement de quatre atomes de carbone consécutifs, hybrides sp2, échangeant deux doublets 神. Du recouvrement latéral des quatre orbitales pz résultent quatre orbitales moléculaires tétracentriques, de symétrie 神; les deux plus stables étant, dans l’état fondamental, liantes et doublement occupées et les deux autres, antiliantes et inoccupées. Le recouvrement maximal des orbitales p z impose le parallélisme des axes z et, par conséquent, la coplanéité des quatre noyaux de carbone et des six autres atomes auxquels ils sont liés par le système des liaisons 靖. La situation de conjugaison du système 神 des diènes conjugués correspond à une énergie de la molécule inférieure d’environ 10 kJ.mol-1 à celle de leurs isomères ayant deux liaisons 神 séparées. Ces hydrocarbures diéniques présentent une bande d’absorption intense dans la région 215-230 nm, qui correspond à une transition 神2神3 et se trouve déplacée de 30 à 35 nm vers les grandes longueurs d’onde par rapport à la bande équivalente des alcènes. De même, la vibration caractéristique en infrarouge est située vers 1 600 cm-1, alors que celle des alcènes se trouve dans la région 1 620-1 690 cm-1.Propriétés chimiquesLes diènes conjugués réagissent, comme les alcènes, dans des réactions d’additions électrophile et radicalaire, mais avec une vitesse généralement supérieure.De plus, les produits, formés au cours d’une réaction en deux étapes, sont souvent des mélanges d’isomères résultant d’additions en position 1,2 et 1,4 et dans des proportions qui dépendent de la température et du solvant. Par exemple, l’addition, à 漣 60 0C, de l’acide bromhydrique au butadiène conduit à un mélange de bromo-3 butène-1 et de bromo-1 butène-2 dans un rapport 4/1; si la réaction a lieu à 40 0C, la proportion des isomères est inversée: 1/4; l’orientation de la réaction est de nature cinétique. À température plus élevée, cette deuxième étape devient réversible et, cette fois, l’orientation est de nature thermodynamique, c’est-à-dire que le produit le plus stable (addition 1,4) est le plus abondant. L’addition du brome à température ordinaire, dans le solvant CCl4, conduit à un mélange de dibromo-1,4 butène-2 trans (95 p. 100) et de dibromo-3,4 butène-1 (5 p. 100). La chloration du butadiène en phase vapeur, à 300 0C, est une réaction radicalaire en chaîne; elle aboutit à un mélange de 3,4-dichlorobutène-1 et de 1,4-dichlorobutène-2 cis et trans . Seul le premier isomère étant utilisé pour la fabrication du chloroprène (2-chlorobutadiène-1,3), on isomérise réversiblement le 1,4-dichlorobutène-2 par chauffage en présence de chlorure cuivreux et on sépare le 3,4-dichlorobutène-1 par distillation. Le chloroprène est obtenu par déshydrochloration de ce dérivé, à 85 0C, à l’aide de soude diluée; c’est un monomère important pour la fabrication de matières plastiques insensibles aux huiles, ainsi que d’adhésifs.Les diènes conjugués donnent lieu à de nombreuses réactions de cycloaddition, notamment avec les composés insaturés activés (Diels-Alder 1928). Ces additions -1,4 sur le diène, d’un composé appelé diénophile, se font généralement par simple chauffage; elles procèdent par un mécanisme concerté. Le diène doit réagir dans sa conformation (la moins favorable) s-cis et l’addition étant réalisée en une seule étape (addition syn ), la configuration du diénophile et celle du diène sont conservées dans l’adduit. La cycloaddition la plus simple est celle de l’éthylène sur le butadiène-1,3: elle se produit à 200 0C et sous pression et conduit, avec un faible rendement (20 p. 100), au cyclohexène (réaction 2 a). La vitesse de réaction est fortement accélérée si le diénophile est activé par des groupes électro-attracteurs et le diène par des groupes électro-donneurs. L’acroléine, l’anhydride maléique, l’acétylène dicarboxylate d’éthyle sont de bons diénophiles; l’isoprène, le 2,3-diméthylbutadiène-1,3, le cyclopentadiène, le furanne sont des diènes réactifs.Cyclooligomérisation : en présence de catalyseur à base de tétrachlorure de titane TiCl4 et de chlorodiéthylaluminium ClAl (C2H5)2, le butadiène se trimérise en formant le cyclododécatriène-1,5,9 accompagné de petites quantités de cyclooctadiène-1,5 et de vinyl-4 cyclohexène. Hydrogéné catalytiquement, cet oligomère donne le cyclododécane, matière première de la fabrication du nylon 12 [cf. AMIDES].Polymérisation : lorsque le diène conjugué est terminal, il peut être polymérisé sous l’action de divers catalyseurs. Le butadiène fut d’abord polymérisé par le sodium, pour former un élastomère appelé Buna (butadien-natrium). La copolymérisation du butadiène et du styrène en émulsion sous l’action catalytique de peroxydes conduit à un caoutchouc synthétique (S.B.R.), utilisé pour la fabrication des pneumatiques. Certains terpolymères à base de butadiène, styrène et acrylonitrile fournissent des matériaux plastiques aux qualités remarquables (résines A.B.S.). Le caoutchouc naturel, qui est un polyisoprène-1,4 cis , se trouve concurrencé par de nombreux polyènes de synthèse, obtenus par polymérisation ou copolymérisation de diènes conjugués (butadiène, isoprène) et de dérivés vinyliques divers.Diènes éloignésCe sont des diènes dont les doubles liaisons sont séparées. Leur préparation fait intervenir les méthodes classiques de synthèse. Un exemple particulier est celui de la synthèse du pentadiène-1,5 par la réaction de Wurtz appliquée au bromure d’allyle: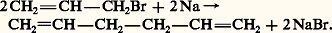 Les diènes éloignés ne présentent aucune anomalie physique ni chimique, les doubles liaisons réagissant de façon indépendante.Seuls les diènes-1,5 peuvent subir, sous l’action de la température, une isomérisation sigmatropique: c’est le réarrangement de Cope (réaction 2 b).PolyènesDeux types de polyènes présentent un certain intérêt:– Les macromolécules polyéniques résultant de la polymérisation des diènes conjugués ou de leur copolymérisation avec des monomères vinyliques (cf. supra ). Le polymère naturel le plus important est le polyprène ou caoutchouc naturel, dont la structure (formule 3 a) est celle d’un polyisoprène-1,4 tout cis . Son isomère, de configuration trans (gutta-percha), ne possède pas les propriétés élastiques du caoutchouc (formule 3 b).– Les polymères entièrement cumulés ou conjugués.Les premiers, appelés cumulènes, sont peu connus et d’accès difficile. Les polyènes entièrement conjugués sont difficiles à obtenir; ils sont caractérisés par des anomalies physiques de conjugaison (effets bathochrome et hyperchrome exaltés). C’est ainsi que, pour cinq doubles liaisons, le produit est jaune, pour onze il est orangé. De nombreux pigments naturels possèdent des structures polyéniques conjuguées: parmi les caroténoïdes, pigments lipochromes présents dans de nombreuses graisses animales et végétales, on peut citer le 廓-carotène (C40H56), constituant majeur du mélange de pigments extraits de la carotte, qui, avec onze doubles liaisons conjuguées, est coloré en orangé. Comme de nombreuses autres, cette molécule est un tétraterpène dont la formule peut être reconstituée par une succession de motifs isopréniques [cf. PIGMENTS]. Chez les vertébrés, et notamment chez l’homme, le 廓-carotène peut subir une coupure oxydante de la double liaison centrale, ce qui conduit à deux molécules d’un aldéhyde, le rétinal. La réduction enzymatique de la fonction aldéhyde donne une vitamine importante, la vitamine A. Le rétinal joue un rôle essentiel dans la chimie de la vision (cf. VISION - Physiologie).
Les diènes éloignés ne présentent aucune anomalie physique ni chimique, les doubles liaisons réagissant de façon indépendante.Seuls les diènes-1,5 peuvent subir, sous l’action de la température, une isomérisation sigmatropique: c’est le réarrangement de Cope (réaction 2 b).PolyènesDeux types de polyènes présentent un certain intérêt:– Les macromolécules polyéniques résultant de la polymérisation des diènes conjugués ou de leur copolymérisation avec des monomères vinyliques (cf. supra ). Le polymère naturel le plus important est le polyprène ou caoutchouc naturel, dont la structure (formule 3 a) est celle d’un polyisoprène-1,4 tout cis . Son isomère, de configuration trans (gutta-percha), ne possède pas les propriétés élastiques du caoutchouc (formule 3 b).– Les polymères entièrement cumulés ou conjugués.Les premiers, appelés cumulènes, sont peu connus et d’accès difficile. Les polyènes entièrement conjugués sont difficiles à obtenir; ils sont caractérisés par des anomalies physiques de conjugaison (effets bathochrome et hyperchrome exaltés). C’est ainsi que, pour cinq doubles liaisons, le produit est jaune, pour onze il est orangé. De nombreux pigments naturels possèdent des structures polyéniques conjuguées: parmi les caroténoïdes, pigments lipochromes présents dans de nombreuses graisses animales et végétales, on peut citer le 廓-carotène (C40H56), constituant majeur du mélange de pigments extraits de la carotte, qui, avec onze doubles liaisons conjuguées, est coloré en orangé. Comme de nombreuses autres, cette molécule est un tétraterpène dont la formule peut être reconstituée par une succession de motifs isopréniques [cf. PIGMENTS]. Chez les vertébrés, et notamment chez l’homme, le 廓-carotène peut subir une coupure oxydante de la double liaison centrale, ce qui conduit à deux molécules d’un aldéhyde, le rétinal. La réduction enzymatique de la fonction aldéhyde donne une vitamine importante, la vitamine A. Le rétinal joue un rôle essentiel dans la chimie de la vision (cf. VISION - Physiologie).
Encyclopédie Universelle. 2012.
